効能・効果
-
春季カタルとはどのような疾患ですか?
春季カタルは重症のアレルギー性結膜疾患※1で、幼少期に発症し学童期を通して慢性に経過します。発症するのは男児に多く、思春期になると自然によくなることも多いようですが、アトピー性皮膚炎が合併している場合は、治りにくい傾向があります。
春季カタルでは、上眼瞼の結膜に石垣状の外観を呈する巨大な乳頭が増殖するため、まぶたの裏側が凸凹になります。このため、まばたきするたびに眼瞼の裏の乳頭増殖と角膜が擦れて痛く、角膜に傷がついて、角膜上皮障害を引き起こします。また、角膜輪部の結膜でも、堤防状の隆起や“Trantas斑”といわれる炎症細胞の浸潤による白色の小隆起などの増殖性変化がみられます。重症例では、角膜にシールド潰瘍(潰瘍底に堆積物が沈着し、遷延性の角膜上皮欠損を伴ったもの)や角膜プラーク(潰瘍内の堆積物が蓄積し、角膜面よりやや隆起して観察されるもの)などの角膜病変を併発します。春季カタルの症状は一年中みられ(通年性)、症状が悪化した時には、激しい眼そう痒感(目のかゆみ)や、角膜上皮障害による異物感、眼痛(目があけていられないほどの強い痛み)、視力低下を自覚します。
春季カタルにおいて、原因となる抗原はハウスダストやダニが多いですが、そのほか花粉、動物のフケなど多種類の抗原に反応することも少なくありません。血清や涙液中総IgE 抗体の増加に加え、血清抗原特異的IgE 抗体や結膜での好酸球陽性率も高率に陽性となります。春季カタルの治療は、抗アレルギー剤の点眼薬をベースに、症状に応じて免疫抑制剤の点眼薬やステロイド剤の点眼薬を併用します。重症例ではステロイド剤の内服薬や瞼結膜下注射、外科的治療を行います。
- ※1:アレルギー性結膜疾患は、「Ⅰ型アレルギー反応を主体とした結膜の炎症性疾患であり、抗原により惹起される自覚症状・他覚所見を伴うもの」と定義されます。
- 参考:アレルギー性結膜疾患診療ガイドライン(第3版)
〈2022/10 作成〉
-
作用機序について教えてください。
タクロリムスはカルシニューリン阻害作用により、in vitroにおけるヒト末梢血由来単核球からのサイトカイン(IL-2,IL-4,IL-5,IFN-γ)産生を抑制することが確認されています(IC50値:0.02~0.11ng/mL)。
作用機序として、タクロリムスは春季カタル患者の結膜において、Th1細胞、Th2細胞、マスト細胞、好酸球等の炎症性細胞の活性化並びにこれらの細胞からのサイトカイン産生を抑制することで、遅発型及び遅延型アレルギー反応を抑え、角結膜炎の進展を抑制するものと推察されており、その中でも主たる作用機序はT細胞からのサイトカイン産生抑制にあると考えられています。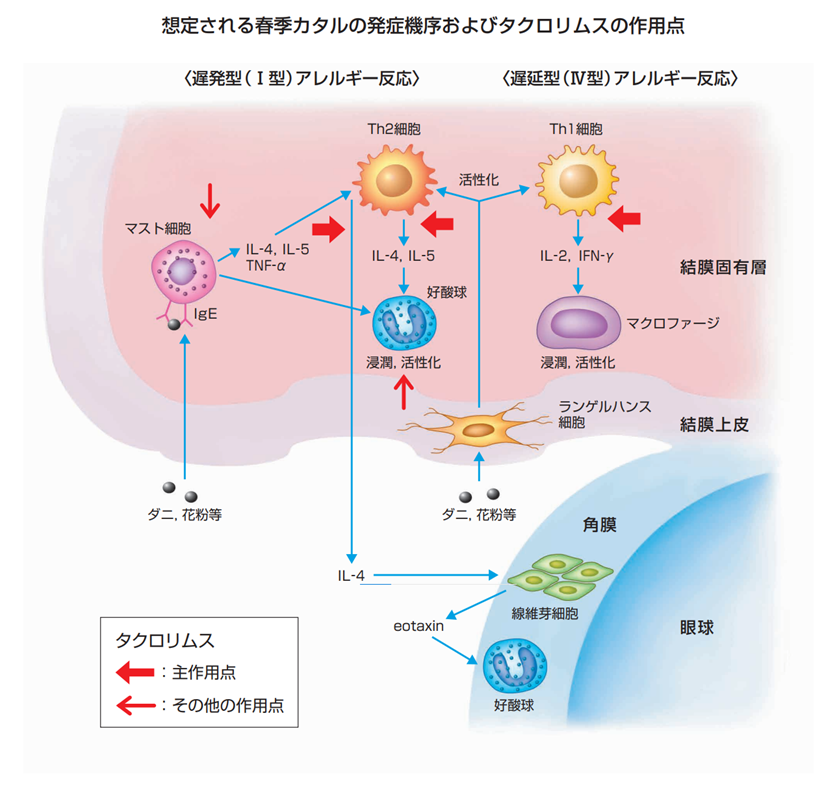
- ※許可なく複写、複製、転送、改変等を行うことはご遠慮ください。
引用
タリムス点眼液0.1%インタビューフォーム Ⅵ.薬効薬理に関する項目 2.薬理作用 (1)作用部位・作用機序〈2022/10 作成〉
用法・用量
-
用法は1日2回点眼ですが、どの時間帯に点眼し、1回目と2回目の点眼間隔はどのくらいあければよいですか?
タリムス点眼液0.1%を点眼する時間帯に特に決まりはありません。異なる時間帯に点眼して有効性および安全性を比較検討した試験は行っていないため、点眼する時間帯によって効果に差がみられるかは明らかではありません。
本剤は1日2回点眼であるため、12時間あけて点眼することをお勧めします。
なお、本剤の治験(第Ⅲ相比較試験)では、1日2回(朝、夕)点眼を行い、有効性及び安全性を確認しています。引用
タリムス点眼液0.1%インタビューフォーム Ⅴ.治療に関する項目 3.臨床成績(5)検証的試験〈2022/10 作成〉
使用について
-
処方時に制限はありますか?
「本剤の使用は、春季カタルの治療法に精通している医師のもとで行うこと」と、添付文書に記載しています。
重症型で難治性のアレルギー性結膜疾患である春季カタルは、抗アレルギー点眼剤で治療が開始されますが、十分な効果が得られない場合はステロイド(点眼、結膜下注射、内服)の併用、外科的治療が行われています。本剤は春季カタルの第一選択薬ではなく、春季カタル治療について精通している医師が病状の活動性などから、本剤とこれらの他の療法との使い分けについて的確に判断する必要があるため記載しました。
引用
タリムス点眼液0.1%インタビューフォーム Ⅷ.安全性(使用上の注意等)に関する項目 6.重要な基本的注意とその理由及び処置方法〈2022/10 作成〉
-
使用前の患者様への説明について
使用後、眼部熱感、眼刺激等が高頻度に認められるので、その旨を患者様に十分に説明してください。
春季カタルの治療の臨床試験において「眼部熱感」、「眼刺激」が高頻度に報告されていますが、大半は数時間以内に回復しており本剤の投与継続が可能であったことから、患者の不安を緩和する必要があると考えています。ただし、高度な症状が持続する場合は、処方医に相談するようご指導ください。自己判断で中止することで病態が悪化する恐れがあります。
引用
タリムス点眼液0.1%インタビューフォーム Ⅷ.安全性(使用上の注意等)に関する項目 6.重要な基本的注意とその理由及び処置方法〈2022/10 作成〉
-
抗アレルギー点眼剤と併用は可能ですか?
春季カタルの治療のために、併用可能です。
抗アレルギー剤の点眼薬だけで効果不十分な中等症以上の症例に対して、タリムス点眼液0.1%などの免疫抑制剤の点眼薬を追加で投与します。- 参考:アレルギー性結膜疾患診療ガイドライン(第3版)
〈2022/10 作成〉
-
ステロイド点眼剤と併用可能ですか?
春季カタルの治療のために、併用可能です。
抗アレルギー剤の点眼薬とタリムス点眼液0.1%など免疫抑制剤の点眼薬との2剤で症状の改善がみられない重症例に対して、さらにステロイド剤の点眼薬を追加で投与します。
症状に応じてステロイド剤の内服薬や瞼結膜下注射、外科的治療も行います。- 参考:アレルギー性結膜疾患診療ガイドライン(第3版)
〈2022/10 作成〉
特殊背景患者
-
眼感染症のある患者が禁忌の理由は?
本剤は免疫抑制作用(Tリンパ球の活性化を特異的に阻害し細胞性免疫応答や抗体産生を抑制する作用)を有しており、眼感染症のある患者に投与すると感染症を悪化させる可能性があるため、禁忌(投与しないこと)としました。
引用
タリムス点眼液0.1%インタビューフォーム Ⅷ.安全性(使用上の注意等)に関する項目 2.禁忌内容とその理由(原則禁忌を含む)〈2022/10 作成〉
-
妊婦へ投与できますか?
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与してください。タクロリムスは妊娠中の投与に関する安全性が確立していません。医師の判断でお使いください。投与される場合には、点眼液の全身への移行が最小限になるよう、点眼後目を1~5分間静かに閉じ、目がしらを軽く押さえるようご指導ください。
なお、本剤は点眼剤ですが、点眼の臨床試験時に血中にタクロリムスが検出されています。また、タクロリムスのウサギを用いた生殖発生毒性試験(0.1~1.0mg/kg、経口投与)では、母動物における体重増加量の抑制、流産、胎仔における形態異常仔数の増加などの催奇形作用、胎児毒性が認められたとの報告があります。そして、ヒト(経口投与)で胎盤を通過することが報告されています。
一方、産科領域など他科の国内外の成書又はガイドラインにおいて、妊娠中であっても使用可能な医薬品として本剤が挙げられています。非臨床試験では催奇形性が認められており、臨床での報告においても奇形を有する児を認めたとの報告がありますが、先天奇形の一般的な発生率と比較して、本剤に曝露した妊婦における先天奇形発生率が有意に上昇したとの報告はありません。引用
- 1)タリムス点眼液0.1%インタビューフォーム Ⅷ.安全性(使用上の注意等)に関する項目 10.妊婦、産婦、授乳婦等への投与
- 2)タリムス点眼液0.1%インタビューフォーム Ⅸ.非臨床試験に関する項目2.毒性試験 (3)生殖発生毒性試験
〈2022/10 作成〉
-
授乳婦へ投与できますか?
授乳中の婦人に投与する場合は、授乳を避けさせてください。本剤の点眼の臨床試験時に血中にタクロリムスが検出されています。タクロリムスは母乳中へ移行したとの報告があり、授乳婦に投与した場合の乳児に対する安全性は確立されていません。医師の判断でお使いください。投与される場合には、点眼液の全身への移行が最小限になるよう、点眼後目を1~5分間静かに閉じ、目がしらを軽く押さえるようご指導ください。
なお、タクロリムスのラットを用いた周産期及び授乳期投与試験(0.32~3.2mg/kg、経口投与)では、母動物及び出生仔の体重増加量の抑制、出生仔生存率の低下などが高用量群で認められたとの報告があります。
引用
- 1)タリムス点眼液0.1%インタビューフォーム Ⅷ.安全性(使用上の注意等)に関する項目 10.妊婦、産婦、授乳婦等への投与
- 2)タリムス点眼液0.1%インタビューフォーム Ⅸ.非臨床試験に関する項目2.毒性試験 (3)生殖発生毒性試験
〈2022/10 作成〉
-
小児等(低出生体重児、新生児、乳児、幼児、小児)へ投与できますか?
低出生体重児、新生児、乳児又は6歳未満の幼児では使用経験はなく、安全性は確立していません。医師の判断でお使いください。投与される場合には、点眼液の全身への移行が最小限になるよう、点眼後目を1~5分間静かに閉じ、目がしらを軽く押えるようご指導ください。
引用
- 1)1) タリムス点眼液0.1%インタビューフォーム Ⅷ.安全性(使用上の注意等)に関する項目 11.小児等への投与
〈2022/10 作成〉
安全性
-
副作用一覧
承認時:
承認時での総症例86例中、副作用は55例(64.0%)に認められました。主な副作用は眼の異常感(眼部熱感、眼の異物感、眼の違和感)38例(44.2%)、眼刺激18例(20.9%)、流涙増加10例(11.6%)でした。
以下に承認時の副作用発現状況一覧を示します。副作用発現状況一覧表(0.1%濃度製剤、1日2回点眼) 安全性評価対象例 86 例 副作用発現例数 55 例(64.0%) 副作用の種類 発現例数(%) 眼障害 眼の異常感 眼部熱感 38例※1
(44.2%)37 例(43.0%) 眼の異物感 1 例(1.2%) 眼の違和感 1 例(1.2%) 眼刺激 18 例(20.9%) 流涙増加 10 例(11.6%) 眼充血 4 例(4.7%) 眼乾燥 3 例(3.5%) 眼痛 3 例(3.5%) 眼精疲労 1 例(1.2%) 眼脂 1 例(1.2%) 羞明 1 例(1.2%) 点状角膜炎 1 例(1.2%) 呼吸器、胸郭および縦隔障害 咽喉刺激感 1 例(1.2%) 咽喉頭疼痛 1 例(1.2%) 咽頭感覚鈍麻 1 例(1.2%) 感染症および寄生虫症 ヘルペス性角膜炎 1 例(1.2%) 眼瞼ヘルペス 1 例(1.2%) 全身障害および投与局所様態 熱感[顔面] 1 例(1.2%) 臨床検査 好中球減少 1 例(1.2%) 単球増加 1 例(1.2%) (承認時社内集計)
- ※1 「眼部熱感」、「眼の異物感」、「眼の違和感」を合わせ「眼の異常感」として扱うが、「眼の異物感」及び「眼の違和感」を併発した症例 1 例含むことから合計発現例数は 38 例となる。
承認の用法・用量以外も含めた、臨床試験(前期第Ⅱ相探索的試験、後期第Ⅱ相濃度設定試験、後期第Ⅱ相点眼回数検討試験、第Ⅲ相比較試験、後期第Ⅱ相継続投与試験、第Ⅲ相継続投与試験)で安全性が評価された全症例の副作用発現状況については次のとおり。
副作用発現状況一覧表(承認の用法・用量以外の症例を含む) 安全性評価対象例数 587 例 副作用発現例数 389 例 臨床試験 前期第Ⅱ相探索的試験 後期第Ⅱ相濃度設定試験 濃度
用法・用量0.01%
1日4回0.03%
1日4回0.1%
1日4回0.01%
1日4回0.03%
1日4回0.1%
1日4回安全性評価対象例数 22 例 20 例 19 例 54 例 54 例 53 例 副作用発現例数 15 例 16 例 16 例 37 例 41 例 39 例 副作用の種類 発現例数 皮膚および
皮下組織障害接触性皮膚炎 ― ― ― ― ― ― 眼障害 眼の異常感 9 例 9 例 12 例 25 例 30 例 27 例 眼刺激 8 例 7 例 6 例 20 例 24 例 19 例 流涙増加 ― 2 例 ― 9 例 8 例 7 例 眼充血 ― ― ― 1 例 1 例 2 例 眼乾燥 1 例 2 例 2 例 1 例 3 例 2 例 眼痛 1 例 3 例 1 例 2 例 6 例 7 例 眼精疲労 ― ― 1 例 1 例 1 例 2 例 眼脂 ― ― ― ― ― ― 羞明 1 例 1 例 ― 1 例 4 例 3 例 点状角膜炎 ― ― ― ― ― 1 例 眼そう痒症 1 例 ― 1 例 1 例 2 例 ― 眼部不快感 ― ― ― ― ― ― 上眼瞼重圧感 ― ― ― ― ― ― 眼瞼そう痒症 ― ― ― 1 例 1 例 ― 眼瞼浮腫 ― ― ― ― 1 例 ― 眼瞼炎 ― ― ― ― ― ― 霰粒腫 ― ― 1 例 ― ― ― 瞼板腺炎 ― ― ― ― ― ― 結膜充血 ― ― ― 1 例 1 例 1 例 結膜浮腫 ― ― ― ― 1 例 ― 結膜炎 ― ― ― ― ― ― 結膜びらん ― ― ― ― ― ― 結膜沈着物 ― ― ― ― ― ― 角膜潰瘍 ― ― ― ― ― ― 角膜混濁 ― ― ― ― ― ― 前房のフレア ― ― ― ― ― ― 前房内細胞 ― ― ― ― ― ― 閃輝性融解 ― ― ― ― ― ― 霧視 ― ― ― 1 例 ― ― 視力低下 ― ― ― ― 1 例 ― 緑内障増悪 ― ― ― ― ― ― 呼吸器、胸郭および
縦隔障害咽喉刺激感 ― ― ― ― ― ― 咽喉頭疼痛 ― ― ― ― ― ― 咽頭感覚鈍麻 ― ― ― ― ― ― 鼻部不快感 ― ― ― ― ― ― 感染性および寄生虫症 ヘルペス性角膜炎 1 例 ― ― ― ― ― 眼瞼ヘルペス ― ― ― ― ― ― 膿痂疹 ― ― ― ― ― ― 麦粒腫 ― ― ― ― ― 1 例 細菌性結膜炎 ― ― ― ― ― ― 単純ヘルペスウイルス結膜炎 ― ― ― ― ― ― 流行性角結膜炎 ― ― ― ― ― ― 全身障害および
投与局所様態熱感[顔面] ― ― 1 例 1 例 ― ― 神経系障害 手指のしびれ感 ― ― ― ― ― ― 臨床検査 好中球減少 ― ― ― ― ― ― 単球増加 ― 1 例 1 例 ― ― ― 眼圧上昇 ― ― ― ― ― ― AST(GOT)増加 ― ― ― ― ― 1 例 γ-GTP 増加 ― ― ― ― ― 1 例 LDH 増加 ― ― ― ― ― 1 例 白血球数増加 ― 1 例 ― ― ― ― 白血球数減少 ― ― ― ― ― ― 好中球増加 ― 1 例 ― ― ― 1 例 リンパ球減少 ― 1 例 ― ― ― 1 例 血中尿酸増加 ― ― ― ― ― ― 臨床試験 後期第Ⅱ相
点眼回数検討試験第Ⅲ相
比較試験後期第Ⅱ相
継続投与試験第Ⅲ相
継続投与試験濃度
用法・用量0.1%
1日2回0.1%
1日4回0.1%
1日2回0.1%
1日4回以下0.1%
1日4回以下安全性評価対象例数 58 例 60 例 28 例 167 例 52 例 副作用発現例数 42 例 55 例 13 例 92 例 23 例 副作用の種類 発現例数 皮膚および
皮下組織障害接触性皮膚炎 ― ― ― 1 例 ― 眼障害 眼の異常感 32 例 32 例 6例 35例 6 例 眼刺激 12 例 31 例 6例 37例 13例 流涙増加 10 例 7 例 ― 11 例 ― 眼充血 4例 3 例 ― 4 例 ― 眼乾燥 2例 2 例 1例 14例 2 例 眼痛 3例 3 例 ― 6 例 1 例 眼精疲労 ― 1 例 1例 ― 1 例 眼脂 1例 ― ― ― ― 羞明 1例 4 例 ― 3 例 ― 点状角膜炎 1例 1 例 ― 1 例 ― 眼そう痒症 ― 1 例 ― 1 例 ― 眼部不快感 ― 1 例 ― ― ― 上眼瞼重圧感 ― ― ― 1 例 ― 眼瞼そう痒症 ― ― ― ― ― 眼瞼浮腫 ― ― ― ― ― 眼瞼炎 ― ― ― 1 例 ― 霰粒腫 ― ― ― 8 例 3 例 瞼板腺炎 ― ― ― 1 例 ― 結膜充血 ― ― ― ― ― 結膜浮腫 ― ― ― ― ― 結膜炎 ― ― ― 2 例 ― 結膜びらん ― ― ― 1 例 ― 結膜沈着物 ― ― ― 1 例 ― 角膜潰瘍 ― ― ― 1 例 ― 角膜混濁 ― ― ― ― 1 例 前房のフレア ― ― ― ― 1 例 前房内細胞 ― ― ― ― 1 例 閃輝性融解 ― 1 例 ― ― ― 霧視 ― ― ― ― ― 視力低下 ― ― ― 1 例 1 例 緑内障増悪 ― ― ― 1 例 ― 呼吸器、胸郭
および縦隔障害咽喉刺激感 ― ― 1例 1 例 1例 咽喉頭疼痛 1例 1 例 ― ― ― 咽頭感覚鈍麻 1例 ― ― ― ― 鼻部不快感 ― ― ― 1 例 ― 感染性および
寄生虫症ヘルペス性角膜炎 ― ― 1例 ― 1 例 眼瞼ヘルペス 1例 ― ― 3 例 ― 膿痂疹 ― ― ― 1 例 ― 麦粒腫 ― ― ― 9 例 3 例 細菌性結膜炎 ― ― ― 1 例 ― 単純ヘルペスウイルス結膜炎 ― ― ― ― 1 例 流行性角結膜炎 ― ― ― 2 例 ― 全身障害および
投与局所様態熱感[顔面] 1例 ― ― ― ― 神経系障害 手指のしびれ感 ― ― ― 1 例 ― 臨床検査 好中球減少 1例 ― ― ― ― 単球増加 1例 ― ― ― ― 眼圧上昇 ― ― ― 1 例 ― AST(GOT)増加 ― ― ― ― ― γ-GTP 増加 ― ― ― ― ― LDH 増加 ― ― ― ― ― 白血球数増加 ― ― ― ― ― 白血球数減少 ― ― ― ― 1 例 好中球増加 ― ― ― 1 例 ― リンパ球減少 ― ― ― ― ― 血中尿酸増加 ― ― ― 1 例 ― 網掛け:承認用法・用量での臨床試験(発現頻度記載根拠)
(承認時社内集計)引用
タリムス点眼液0.1%インタビューフォーム Ⅷ.安全性(使用上の注意等)に関する項目 8.副作用 (4) 項目別副作用発現頻度及び臨床検査値異常一覧〈2022/10 作成〉
貯法
-
保管方法と開封後の使用期限は?
直射日光の当たらない涼しい場所で保管してください。保管温度は室温(1-30℃の範囲)です。冷蔵庫での保管も可能です。ただし、凍結しないようご注意ください。開封後の使用期限は1ヵ月を目安に使用してください。
また、本剤は振り混ぜても粒子が分散しにくくなる場合がありますので、懸濁粒子が空気に触れないように、薬局では上向きに保管してください。〈2022/10 作成〉
-
使用前までは、上向きに保管する理由は?
懸濁剤の場合、懸濁の粒子が沈んで点眼瓶の底にたまるため、点眼する際にはよく振ってから使います。この場合、沈降した粒子が薬液の中に留まっていれば問題なく分散しますが、点眼瓶を横倒しの状態で保管すると、正立(上向き)に戻した際に点眼瓶の壁に残った粒子が空気に触れて凝集し、振り混ぜても粒子が分散しにくくなる可能性があります。
ただ、本剤の粒子は非常に小さく、一度分散させると粒子が沈降するのに1ヵ月以上かかります。開封後は1ヵ月を目安にお使いいただくため、患者様が使用し始めてからは、上記のような凝集して固まって分散不良が起こる可能性はないと考えます。薬局で保管する場合は、使用開始まで正立(上向き)で保管してください。もし患者様に複数本処方された場合は、“開封前の点眼瓶を正立(上向き)保管する”旨を患者様にご指導ください。〈2022/10 作成〉
服薬指導
-
容器のフィルム(ラベル)を剥がしてもよいですか?
本剤は外箱開封後の光に対する安定性を確保するために、直接の容器に遮光性のシュリンクフィルムを施してあります。
使用開始時にはキャップを開けるためにキャップ部分のフィルムを取り除きますが、容器本体のフィルム(ラベル)まで取り除くと遮光効果は得られません。このため、本剤を患者様に渡す際には、“遮光性のあるフィルムで製品の品質を保持しているため容器本体のフィルム(ラベル)は絶対に取り除かない”旨をご指導ください。引用
タリムス点眼液0.1%インタビューフォーム Ⅷ.安全性(使用上の注意等)に関する項目 14.適用上の注意 (3) 薬剤交付時〈2022/10 作成〉
-
点眼時の注意点はありますか?
- ●よく振り混ぜてから、点眼してください。
- ●点眼後1~5分間閉瞼しながら涙嚢部を圧迫してください。点眼液は鼻涙管を経由して鼻咽頭粘膜から全身へ吸収されることがあります。閉瞼及び涙嚢部を圧迫することにより、全身への吸収を抑制して治療効果を高め、また全身性の副作用を防ぐことができると考えられます。
- ●点眼したときに薬液が眼瞼皮膚等についた場合は、そのままにしておくと目のまわりがかぶれたりする恐れがありますので(眼瞼炎等)、すぐにふき取ってください。
- ●点眼のとき、容器の先端が直接目に触れると、雑菌や目やになどが薬液中に入って、薬液が汚染されることが考えられるので、直接目に触れないように注意してください。
- ●本剤は外箱開封後の光に対する安定性を確保するために、直接の容器に遮光性のシュリンクフィルムを施してあります。容器本体のフィルム(キャップ部分は含まない)を取り除かないでください。
引用
タリムス点眼液0.1%インタビューフォーム Ⅷ.安全性(使用上の注意等)に関する項目 14.適用上の注意〈2022/10 作成〉
-
他剤と併用する場合の点眼順序と間隔はどうすればよいですか?
点眼順序、併用間隔等の点眼の仕方について、医師の指導がある場合にはそれに従ってください。
指導がなかった場合は、併用する点眼剤の添付文書に従ってください。添付文書にも記載が無い場合、点眼順序はどちらが先でも構いません。
また、併用間隔については、他の点眼剤との点眼間隔が短い場合、先に使用した点眼剤の吸収が不十分となり効果が現れにくくなります。また、先に使用した点眼剤と後に使用した点眼剤が配合変化を生じる可能性があるため、少なくとも5分以上の間隔をあけてから点眼するよう患者様へご指導ください。引用
タリムス点眼液0.1%インタビューフォーム Ⅷ.安全性(使用上の注意等)に関する項目 14.適用上の注意 (2)投与時〈2022/10 作成〉
-
コンタクトレンズを装用したまま点眼可能ですか?
春季カタルは重症のアレルギー性結膜疾患です。患者様の眼表⾯の状態などを考慮して、弊社ではコンタクトレンズ(CL)の装⽤をお勧めしません。
医師が患者様のCL装⽤を認めた場合は、ハード(酸素透過性)・ソフトを問わず、いずれのCL もはずしてタリムス点眼液0.1%を点眼し、5分以上あけてから再装⽤ください。CLを装⽤しての有効性・安全性を確認していません。
ただ、治療中におけるCL装⽤の可否やCL装⽤時の点眼可否については、患者様の病態に応じて、最終的には診察された医師にご判断いただく必要があります。患者様の治療状況とアドヒアランス等を考慮して患者様ごとにCL装⽤ならびにCL装⽤時の点眼可否をご判断ください。
※当情報を、許可なく複写、複製、転送、改変等を⾏うことはご遠慮ください。
〈2023/02 作成〉
- お問い合わせ
-
カスタマーサポート室
受付時間: 9時~17時30分(土曜日、日曜日、祝日を除きます)
FAX番号:06-6201-0577 ※お問い合わせやご意見等について、内容を正確に把握し、回答および対応の質の維持・向上のため通話を録音させていただいております。予めご了承ください。 ※当社は日本製薬工業協会が提唱するくすり相談窓口の役割・使命に則り、くすりの適正使用情報をご提供しています。 ※患者さん・ご家族の皆さまからの個人の病状や病気の診断・治療に関するご相談は受けたまわっておりません。






